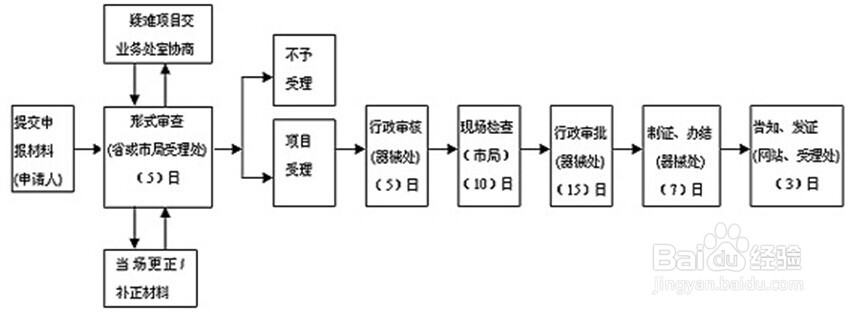
国内二,三类医疗器械生产许可流程及文件
1、申请:
(1)网上提交。在递交书面申报材料前,应通过企业网上办事平台(http://219.135.157.143)进行网上申报,凭申报成功后取得的预受理号到受理大厅办理后续工作。
(2)窗口提交。
接收部门:各市食品药品监督管理局受理窗口或省食品药品监督管理局业务受理处。
2、受理
1.补正材料。申请材料存在可以当场更正的错误的,允许申请人当场更正;申请材料不齐全或者不符合法定形式的,当场或者在五日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理。
2.受理或不予受理凭证。申请被受理的,申请人可获得实施机关出具的受理凭证;申请不被受理的,申请人可获得实施机关出具的不予受理通知书,不予受理通知书的内容包括不予受理的理由。
办理时限:5个工作日内
3、资料审查及现场核查
由省局、自治区、直辖市(省药监局)专业人士对提交资料进行审查。不符合要求则发出补正告知。并定下现场审核时间。
行政审核(5个工作日)
4、现场审核:
由省局、自治区、直辖市(省药监局)专业人士去到企业工厂对生产环境,生产设备等条件进行审核,不符合要求者需要进行整改。
办理时限:10个工作日内
5、行政审批:
对受理、技术审评的审查内容和审评过程进行行政复核,并根据技术审评结论作出批准注册或不予行政许可的决定。
办理时限:15个工作日内
6、批件制作和送达
(1)准予许可:审批证件为《医疗器械生产企业许可证》,有效期五年。申请人需要延续依法取得的《医疗器械生产企业许可证》》有效期的,应当在有效期届满前6个月提出申请。
(2)不予许可:对不予许可的,按照审批的内容制作《不予行政许可决定书》
办理时限:10个工作日。
7、总体流程图
注:由于各省级食品药品监督管理局规定有细微差异,具体可详见企业所在地省级食品药品监督管理局规定