如何做出一张好的免疫荧光片子(很详细)
1、 首先油笔画圈,再利用4%PFA溶液固定切片20min,注意4%PFA要用PBS配制,否则容易引起细胞肿胀,免疫荧光最好的效果不好,固定完,1*PBS洗3次。

2、 0.4%tritonx-100,通透10min,室温,然后1*PBS洗3次。
3、 3%BSA对每个标本封闭1h,室温。
4、 封闭过后,不必洗,而是要把多余的BSA吸走,一抗孵育4度过夜,我用的是抗opsin抗体。
5、 第二天1*PBS洗3次,洗去未结合的一抗,然后孵育二抗,室温40分钟,注意你的二抗是488还是594的,因为不同的激发光的颜色是不一样的,我用的594发红光。
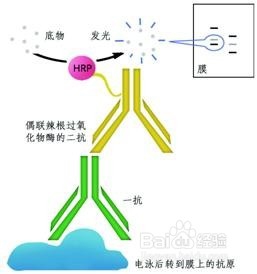
6、 二抗孵育完毕,1*PBS洗3次洗去未结合的二抗,滴加DAPI用干净的盖玻片封片
7、 荧光显微镜观察。
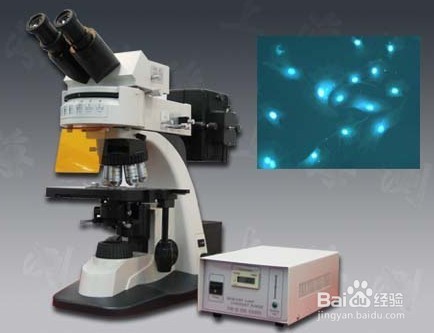
8、 让大家看看我用rhodopsin做的图片哦
声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。
阅读量:72
阅读量:57
阅读量:105
阅读量:175
阅读量:118