离子反应及离子方程式
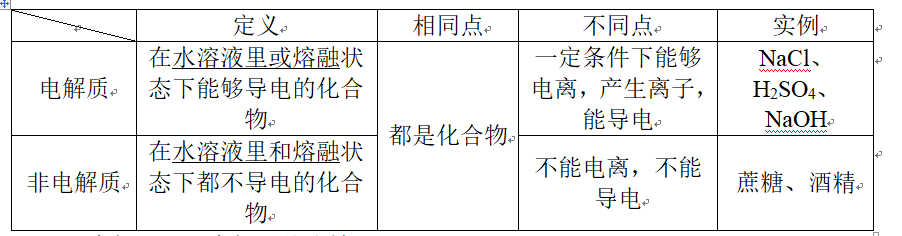
1、一、电解质和非电解质的比较
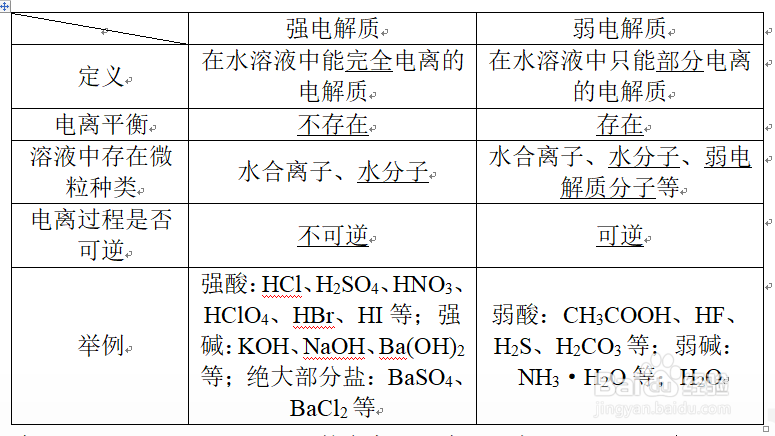
2、二、强电解质和弱电解质的比较
3、三、电离
1.概念:电解质在水溶液中或熔融状态下离解成自由移动的离子的过程。
2.电离条件:酸的电离条件是溶于水,盐和碱的电离条件是溶于水或熔融。
4、四、电离方程式的书写
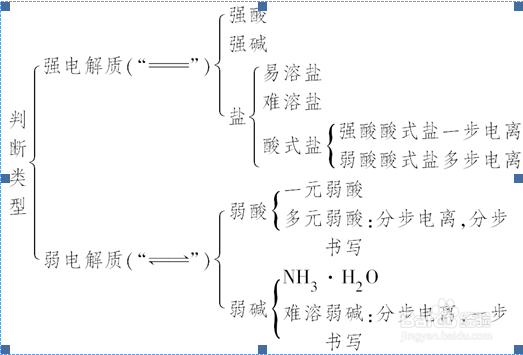
1.强电解质:完全电离,用“===”表示。
如H2SO4、NaOH、(NH4)2SO4的电离方程式分别为H2SO4===2H++SO、NaOH===Na++OH-、(NH4)2SO4===2NH+SO。
2.弱电解质:部分电离,用“可逆号”表示。

5、五:高中阶段特殊的电离
(3)两性氢氧化物双向电离。如Al(OH)3的电离方程式
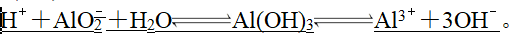
6、3.酸式盐
(1)强酸酸式盐完全电离,一步写出。如NaHSO4在水溶液中的电离方程式为NaHSO4===Na++H++SO,在熔融状态下的电离方程式为
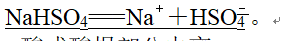
7、(2)多元弱酸酸式盐,第一步完全电离,酸式酸根部分电离。
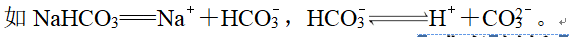
8、典例
下列说法正确的是( )
A.NaHSO4在熔融状态下的电离方程式为NaHSO4===Na++H++SO
B.H2CO3是弱酸,故Na2CO3是弱电解质
C.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
D.NaHCO3在水溶液中的电离:NaHCO3===Na++HCO、HCOH++CO

9、电离方程式书写的思维模型
1、一、离子反应发生的条件
1.复分解反应类型
(1)生成难溶性的物质,如Al(OH)3、BaSO4等。
(2)生成难电离的物质,如弱酸、弱碱、水等。
(3)生成易挥发性的物质,如CO2、SO2、NH3等。
2、2.氧化还原反应类型
强氧化性物质+强还原性物质―→弱氧化性物质+弱还原性物质。
如FeCl3溶液与Cu反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+。
3.络合反应:生成稳定的络合物或络合离子。
如向FeCl3溶液中滴入KSCN溶液时反应的离子方程式为Fe3++3SCN-Fe(SCN)3。(高中唯一一个络合物)
3、3.书写步骤(以CaCO3与盐酸的反应为例)

4、在做离子方程的问题时的思路
1、类型一 连续反应型
指反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。
如CO2通入NaOH溶液中:
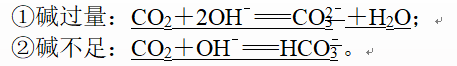
2、(2)多元弱酸(或其酸酐)与更弱的酸的盐溶液反应。
如CO2通入NaAlO2溶液中:
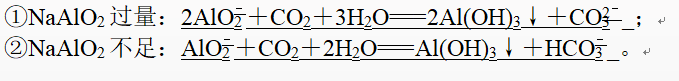
3、(3)多元弱酸盐与强酸反应。
如Na2CO3溶液与稀盐酸:
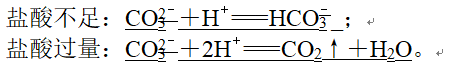
4、(4)铝盐溶液与强碱溶液:
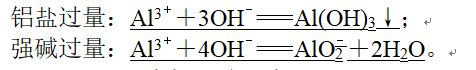
5、(5)NaAlO2溶液与强酸溶液:
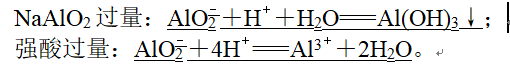
6、(6)Fe与稀HNO3溶液:
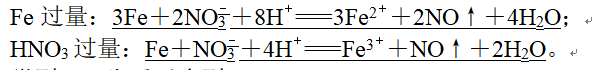
7、类型二 先后反应型
一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关。又可称为竞争型。
NH4HSO4溶液与NaOH溶液的反应:
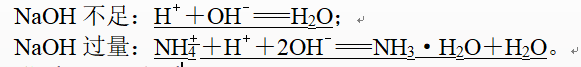
8、类型三 配比型
当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足)而跟用量有关。
(1)Ca(HCO3)2溶液与NaOH溶液:
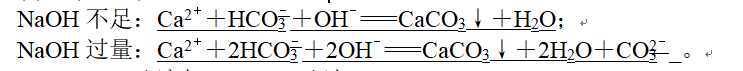
9、(2)NaHSO4溶液与Ba(OH)2溶液:
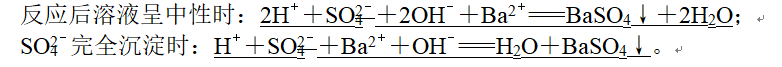
10、(1)根据相对量将少量物质定为“1 mol”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。
(2)依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。
(3)依据“先中和后沉淀”的思路正确书写离子方程式。
1、(1)“拆分”陷阱
离子方程式的正误判断中,常常设置物质是否能“拆分陷阱”,氧化物、弱电解质、沉淀、酸式酸根(HSO4除外)在离子方程式中均不能拆分。在复习时,应熟记常见的弱电解质、溶解度表及常见多元弱酸的酸式酸根。
2、(2)“守恒”陷阱
离子方程式除符合质量守恒外,还应符合电荷守恒,学生往往只注意质量守恒,而忽略电荷守恒,这也是命题者经常设置的“陷阱”。
3、(3)“原理”陷阱
离子反应应符合客观事实,而命题者往往设置不符合“反应原理”的陷阱,如Fe和非氧化性酸反应应生成Fe2+,金属和氧化性酸反应不放出H2。注意不要忽略隐含反应,是否符合配比关系,“===”、“”使用是否正确以及反应条件等。
4、(4)“量比”陷阱
在离子方程式正误判断中,学生往往忽略相对量的影响,命题者往往设置“离子方程式正确,但不符合相对量”的陷阱。突破“陷阱”的方法一是审准“相对量”的多少,二是看离子反应是否符合该量。